構造生物学研究センター設立の考え方
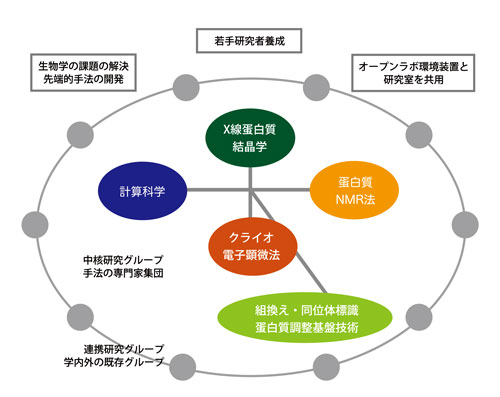
平成19年(2007年)2月の設置届けでは、当センター設置目的を次のように述べている。「理学研究科は、本学の生命科学研究をさらに強化するため、構造生物学の研究手法の導入と実行、かつ独自の研究手法の開発を目的として、理学研究科に構造生物学研究センターを設置する。今日、すべての生命現象の理解のためには、中心となる分子複合体の原子構造、動態、細胞内配置と移動の解明が必須となっている。本センターでは、X線結晶学、電子顕微法、NMR法、計算科学、の4手法を中心に、光学顕微法などの専門チームを誘致し、既存の生命科学関係研究室と有機的連携をとって先端的研究拠点を形成する。」
構造生物学の重要性:
すべての細胞機能は中心となる蛋白質複合体によって、特に複合体中の蛋白質相互作用によって、担われる。現代の生命科学は、それら蛋白質相互作用を物理・化学の言葉で理解することを目標とする。そのためには、蛋白質複合体の原子レベルの構造の解明と、蛋白質相互作用の原子レベルでの理解が必須である。この作業には構造生物学の研究手法が必要である。
構造生物学のフロンティアの拡大:
構造生物学は単に多くの蛋白質の結晶構造を解明することではない。むしろ近年の構造生物学の急速な進歩によって構造生物学のフロンティアは以下のように急速に拡大している。
第一に細胞内部に向かっての拡大: これまで構造解析の対象は細胞外に取り出した蛋白質試料であったが、近年細胞内での構造、個数、空間配置などの解明が可能になってきた。解明すべき課題は無数にある。
第二に難度の高い大きな複合体への対象の拡大: 細胞機能に重要な役割を担うのは大きな蛋白質複合体であったり、あるいは膜蛋白質であったり、線維状蛋白質複合体であったりで、これらの原子構造は従来のX線蛋白質結晶学では解明できなかった。しかし近年の電子顕微鏡構造解析法の急速な進歩によってこれらの解明が可能となってきた。
第三に蛋白質内部に向かっての拡大: 蛋白質複合体の作用機構を解明するには、静止した構造解明だけでは不十分であり、蛋白質内部の構造の揺動(構造動態)の理解が必要であることが広く認識されている。そして、計算機実験とNMR法の双方を使って蛋白質構造動態の解明が進み始めている。
以上の構造生物学フロンティアの拡大によって、多くの細胞機能のメカニズムが実際に蛋白質相互作用の物理・化学として解明されるようになった。この成功によってより多くの生命科学分野に構造生物学の手法が浸透しつつある。
研究拠点の意義:
上述のように構造生物学の研究手法は急速に進歩し、対象も急速に拡大しており、生命科学での重要性も増している。それゆえ、名古屋大学としても構造生物学を生命科学の一分野として重視し、構造生物学分野で独自の貢献をして世界に発信することが重要である。また、構造生物学では研究手法の開発のために高度な専門的力量を持つ人材を系統的に集める必要があり、大型装置の運用も必要である。当センターは以上を可能とする構造生物学分野での名古屋大学の研究拠点として設立された。
センターの活動の2本の柱:
当センターでは、(1)センター内で独自に最先端の研究手法を開発する活動と、(2)生命科学の特定の分野の課題の解決に取り組む活動を2本柱として推進した。これによって、手法の開発研究が生命科学の文脈から解離する危険を避ける事ができるし、開発された研究手法はすぐに具体的な生物学的課題の解決に生かされ研究手法の価値を明確にできる。
若手研究者の育成:
センターは全学に対する貢献として、生命科学他分野から若い研究者を受け入れ、構造生物学手法も駆使できる研究者(2つ以上の専門性を持つ研究者)として養成する。特定の生命科学分野の課題に精通すると同時に、構造生物学の手法を駆使できる研究者こそ今後の生命科学研究の中心的担い手となろう。サービス業務は請け負わない:
構造生物学の研究では、試料蛋白質と解明すべき目標によってそのたびに研究手法の改良が必要がある。よってほとんどの研究は共同研究としてはじめて可能であって、機械を操作すれば半ば自動的に結果が出るものではない。よって、当センターはサービス業務を請け負うことはしない。複数の研究手法を組み合わせる:
設立目的では「X線結晶学、電子顕微法、NMR法、計算科学、の4手法」を組み合わせて使うことのできる環境整備を重視した。これらの方法はどれも原子レベルの構造情報をもたらし、互いに相補的である。相補的であるゆえ組み合わせると、多くの新発見や新しい実験のアイデアに結実する。
X線蛋白質結晶学は、最も容易に蛋白質の原子座標を解明できるが、結晶を調製する必要があり、得られた原子座標は静的な位置情報であり、結晶格子内での制約に縛られる。
クライオ電子顕微鏡法は、得られる分解能には限界がある(現在の到達点は3-4 Å 分解能)が、大きな複合体の構造を、生理的状態に近い状態で、工夫次第では細胞内にある状態で解明できるという利点がある。
蛋白質NMR法は、近接原子の相互影響の情報であるので全体の形態を見ることは不得意であるが、蛋白質分子間の接触の詳細や、各原子の動的振るまい(1/10秒の時間領域まで)を計測できるという利点がある。
計算科学は、原理的には水分子を含めた全ての原子の位置の刻々の変化を追跡できる、つまり蛋白質の構造変化を予測できるが、計算機の能力の制約より、通常追跡できる時間が100 nsec 程度に限られる。また、大きな構造変化は予測できない。そのため現象の全体的理解を得にくい。
当センターの運営上は以上4つの方法に加えて、組換え・同位体標識蛋白質調製技術を共通の基盤技術として重視した。ただし計算科学分野ではセンター内にグループを新設せず、名古屋大学内ですでに活動する多数の優れた研究チームとの連携を重視した。この分野では特に大きな設備投資は不要であり研究拠点に取り込む必要はない。
施設・装置・スペシャリストの集積:
X線結晶学、電子顕微法、NMR法のすべての方法において、大型装置を使うことが避けられず、これらの装置は研究室単位では購入(開発)・運用することができない。しかも、電子顕微法、NMR法は、方法も装置も急速な進歩途上にある。これらの理由から、独自の方法開発をしながら、装置を運用するスペシャリストを擁する必要がある。
(文責:前田雄一郎)
構造生物学研究センターの経緯(概略)
- 平成16年 (2004年) 4月、前田が理学研究科生命理学分子生物第3講座担当として赴任。
- 平成18年 (2006年) 4月、SAIL-NMR法の開発者である甲斐荘正恒博士をCOE特任教授として名古屋大学に招へい。平成20年1月、名古屋大学は甲斐荘正恒を特別招聘教授に任命した。
- 平成19年 (2007年) 2月、理学研究科附属として構造生物学研究センターが設置された。当面の蛋白質試料調製、生化学実験、および研究室機能のために高等総合研究館地下階の200平米を借用した。
- 平成19年 (2007年) 3月、共同教育研究施設内第二実験棟に「NMR棟」(310平米)を建設し、蛋白質NMR装置3基(800、600、500 MHz)および600MHz、500MHz用クライオ・プローブを首都大学東京より移設し運用を開始した。
- 平成19-23年度 (2007-2012年度)、グローバルCOEプログラム「システム生命科学の展開:生命機能の設計」が採択され、構造生物学研究センターはその実施機関の一つとなった。
- 平成21年(2009年)3月、JST-ERATO前田プロジェクト終了に伴い、X線結晶構造解析装置および生化学装置一式および上記のNMR3基とその建屋も名古屋大学に無償供与された。
- 上記の実験装置一式の移転に伴い、第二実験棟PCB保管庫2階を開発・改造し4棟のプレハブを設置し、試料蛋白質の調製・生化学実験室として使用開始した。
- 平成21年度 (2009年度) 政府補正予算で900 MHz NMR装置の購入が決定され、平成23年 (2011年) 3月に納入された。現在活発に使用されている。
- 平成23-27年度 (2011-2015年度)、名古屋大学から文科省への概算要求が認められ、文科省特別経費による「蛋白質ダイナミックス構造生物学の推進」事業が始まった。
- 平成23年 (2011年) 12月、地球環境系総合研究棟建設のため、第二実験棟の東半分が取り壊され、同棟2階の当センターの研究スペースも消失した。この代替えとして大学本部から高等総合研究館4階に350平米を斡旋された。それに、地下階で借用していた実験室のうち150平米、創薬研究科の創設に伴い赴任した廣明教授・児玉准教授の研究スペース200平米を加えて、高等総合研究館4階が700平米に統合した。これにより当センターは4階を一体として効率的に利用し、蛋白質調整・生化学作業および研究室スペースとした。なお第二実験棟西側半分のNMR棟および倉庫スペース (計350平米) は継続して使用。
- 同時に電子顕微鏡1台の所属変更(エコトピア科学研究所臼倉教授より理学研究科へ)に伴い、高等総合研究館地下階に電子顕微鏡スペース約30平米を確保した。隣接するJST臼倉プロジェクト用70平米と合計100平米を電子顕微鏡実験室として使用開始。
- 平成24年 (2012年) 4月、構造生物学研究センター設置の5年間延長が認められた。3月、前田の定年退任に伴い、遠藤斗志也教授がセンター長に就任した。
- 平成24年度 (2012年度) から最長5年間、当センターは文科省・創薬等プラットフォーム整備事業・相関構造解析のNMR研究実施施設として受託研究を実施することになった。
- 平成24年度 (2012年)9月、特別経費を使って購入した電子顕微鏡用CCDカメラ(4,000 x 4,000pxl)(エネルギー・フィルダー共)がTecnai-Polaraに装着され運用が開始された。このカメラはアクチン繊維など細長い試料の撮影に向いている。Tecnai-Polaraはエコトピア科学研究所所属であるが、これを機に当センターも共用を開始した。
- 平成25年 (2013年度) 3月、平成24年度(2012年度)の特別経費を使って、NMR機器の更新と拡充を実行し、NMR 5基(900 , 600, 600, 500, 500 MHz)体制となった。これらの装置はほとんどフルに活用され、関係スタッフの貢献、好立地条件と相まって、我が国のトップレベルの蛋白質NMR研究拠点となった。
(文責:前田雄一郎)
