|
|
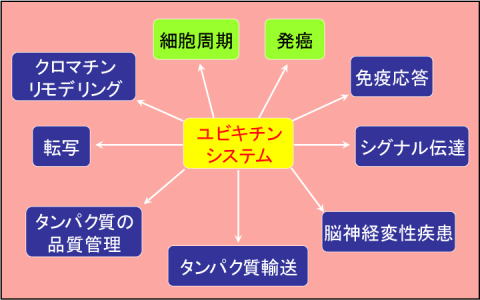
私たちの体の中でタンパク質は、必要なときに合成され、その役目を終えると分解されています。従来タンパク質はその合成過程で厳密にコントロールされ、分解過程は細胞内で不要になったものの単なるゴミ処理機構と考えられていました。しかしながら近年の研究により、実はタンパク質分解もさまざまな生体機能を積極的にコントロールする制御系であることが明らかになり、非常に関心を集めています。私たちは、この中でもユビキチン・プロテアソーム系を介したタンパク質分解により制御される生命現象に注目し研究しています(図1)。 |
|---|
 |
|---|
| 図1 ユビキチンシステムが制御する様々な生命現象 |
|
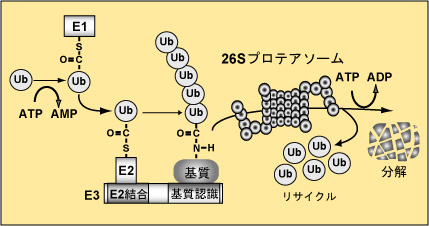
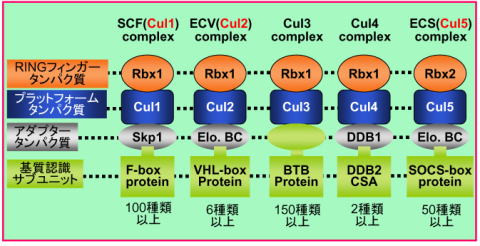
ユビキチンシステムに制御される生命現象の解明 ユビキチンは発見された際に細胞内に普遍的(ユビキタス)にあることよりこのように命名された分子量8.6 kDaの小さな分子です。ユビキチンは、E1、E2、E3の三種類の触媒酵素群を介して標的タンパク質へ付加されます。タンパク質にユビキチンが付加されますと、分解シグナルとなり細胞内分解装置のプロテアソームに運ばれ分解されます(図2)。たんぱく質へのユビキチン修飾はこのように三種類の酵素群によって触媒されますが、なかでもE3は、特異的に基質を認識し分解に導くという重要な役割を担っており、私たち哺乳類では700種類近くと膨大な数が存在します。E3は大きく分けて、HECT型、U-box型、RING-finger型に分類されます(図3)。RING-finger型E3は数が多く、細胞周期制御や発癌などに重要な役割を果たします。私たちは、この中でもCullin型E3に焦点を絞って研究を進め、Cullin型E3の共通構成因子Rbx1の発見あるいはCul2やCul5型E3に対する新たな知見を報告してきました。そして現在これらE3により特異的にユビキチン化される基質の同定さらにはこれら酵素・基質関係により制御される生命現象解明を目的として研究を進めています。
|
|---|
 |
|---|
| 図2 ユビキチン・プロテアソーム系を介したタンパク質分解機構 |
 |
|---|
| 図3 Cullin-Rbx型E3ユビキチンリガーゼ |
|
2) 発癌とユビキチンシステム |
|---|
 |
|---|
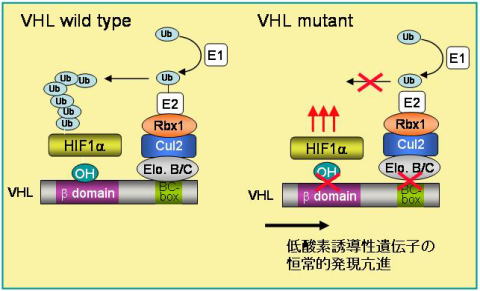
| 図4 ECVVHL複合体によるHIF-alphaの分解機構 |
|
3) ユビキチンシステムを用いた標的タンパク質除去 |
|---|
 |
|---|
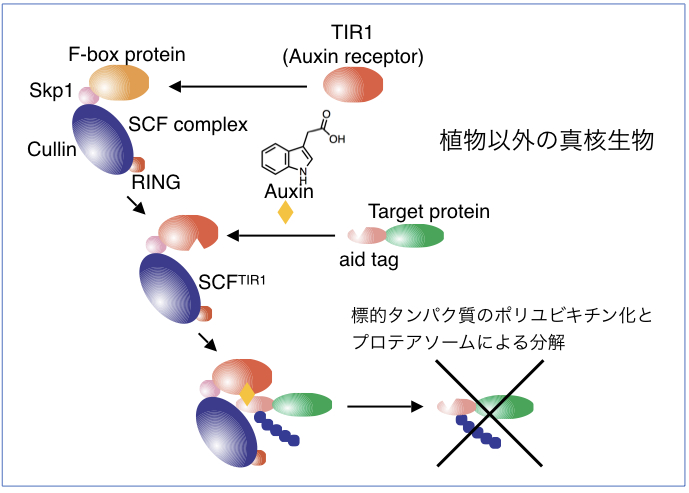
| 図5 植物ホルモン・オーキシンを用いたタンパク質分解システム(AID法) |
| 最近の研究紹介 |
| 1) Obara, K., Higuchi, M., Ogura, Y., Nishimura, K., Kamura, T. Rapid turnover of transcription factor Rim101 highlights a flexible adaptation mechanism against environmental stress in Saccharomyces cerevisiae. Genes to Cells, 25(10), 651-662 (2020) |
| 細胞は様々な細胞外ストレスに曝されている。細胞外ストレスはしばしば単一ではなく、様々な種類と強度のブレンドとして襲い掛かる。細胞がそれら無数のパターンに対して各種ストレス応答経路をチューニングして総合的に最適な細胞応答を引き起こす仕組みは明らかになっていない。本研究では、外界のpH上昇(アルカリ化)に対する応答経路であるRim101経路を題材にして研究を行った。Rim101経路では転写因子Rim101が切断を受けて活性化する。私達は、切断前および切断後のRim101がともに半減期約15分という短寿命なタンパク質であり、プロテアソームで素早く分解されることを見出した。切断活性型のRim101が蓄積すると、アルカリストレスに対する耐性は亢進したが、カドミウムストレスに対しては超高感受性を示した。逆にカドミウムストレス応答経路を引き起こす転写因子を過剰発現するとアルカリストレスに対して脆弱になった。すなわち、両経路は互いに両立しづらく、負のインパクトを与え合うbad chemistryな関係にあることが明らかになった。本研究の意義は、活性化したストレス応答経路を迅速に不活性化することが他のストレスに柔軟に対応するために必要であることを初めて明確に示した点にある。また、ストレス応答経路同士の相互作用マップの描画という大きなゴールに向けた第一歩でもある。 |
| 2) Nishimura, K., Yamada, R., Hagihara, S., Iwasaki, R., Uchida, N., Kamura, T., Torii, U.K., and Fukagawa, T. A super-sensitive auxin-inducible degron system with an engineered auxin-TIR1 pair Nucleic Acids Research (2020) Online methods.DOI:10.1093/nar/gkaa748 bioRxiv (2020) doi: https://doi.org/10.1101/2020.01.20.912113 |
| 生物を構成する細胞の中では様々なタンパク質が機能することにより、生命現象が維持されています。細胞の中の特定のタンパク質の役割を解析するためには、そのタンパク質を細胞内から除去してしまい、細胞に現れる表現型を解析する方法が一般的です。標的とするタンパク質を細胞内から速やかに分解・除去するシステムとして植物ホルモン・オーキシンを用いたオーキシンデグロン法が存在しており、世界中で様々なタンパク質の機能解析に用いられています。今回、研究グループは人工的に改変したオーキシン分子とその受容体のペアを用いることによって、従来のオーキシンデグロン法よりも1000倍も高感受性なオーキシンデグロン法(Super-sensitive AID system)を開発することに成功しました。この方法では標的タンパク質の分解に必要なオーキシンの量を従来よりも1000分の1にまで減少させることができるため、オーキシン自身の細胞毒性を低く抑えることができます。この方法はマウスやヒトの様々な細胞で機能することがわかっており、今後、これらの細胞でタンパク質の速やか、かつ低毒性な分解系として様々なタンパク質の機能解析や創薬での利用が期待されます。 |
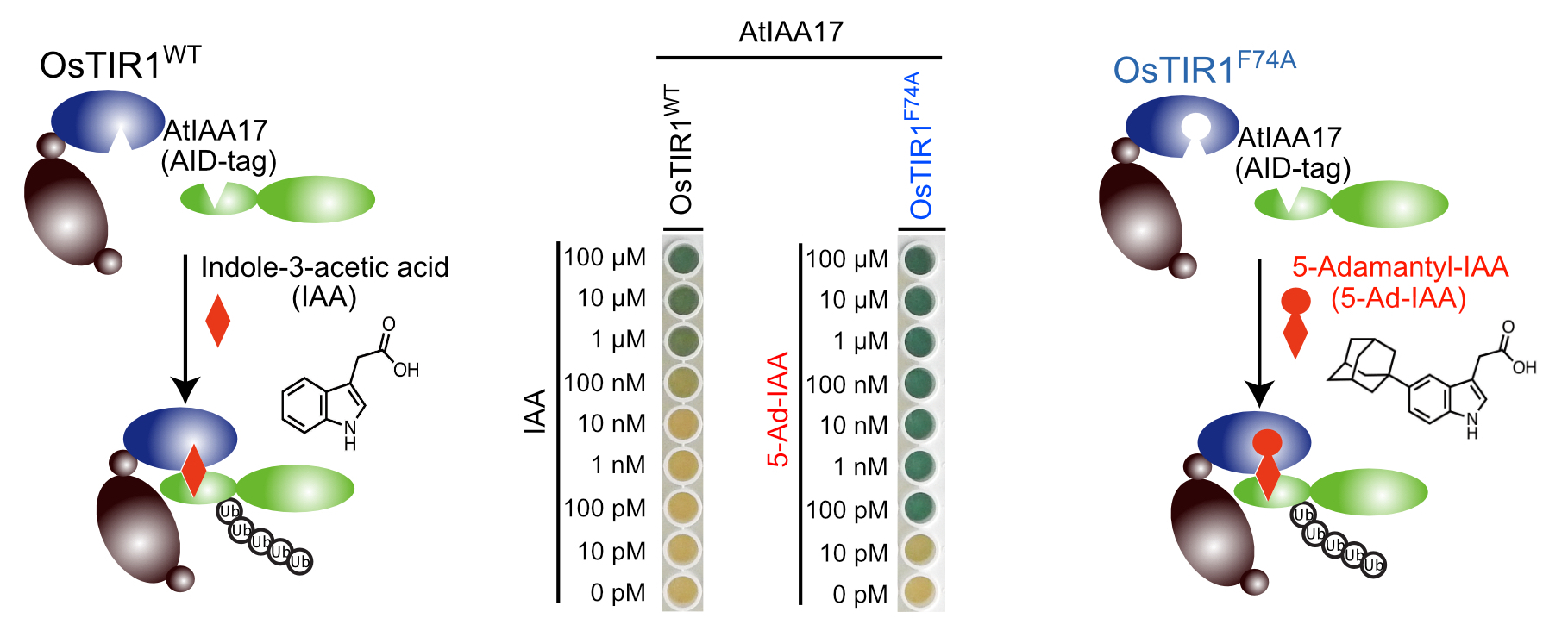 |
| 人工合成オーキシン5-Ad-IAAとOsTIR1F74Aを用いた高感度オーキシンデグロン法 |
| 3) Obara, K., Kotani, T., Nakatogawa, H., Kihara, A., and Kamura, T. N-glycosylation of Rim21 at an unconventional site fine-tunes its behavior in the plasma membrane. Cell Structure and Function, 45(1), 1-8, (2020) |
| 細胞膜の脂質二重層では内層と外層で脂質組成や役割が大きく異なっており、その様な現象は脂質非対称と呼ばれる。脂質非対称性を適切に形成・調節することは生命の維持に不可欠であり、これが破綻すると細胞一つとして生存出来ない。私達は、脂質非対称の状態が乱れた際に活性化して適応反応を引き起こす脂質非対称センサータンパク質Rim21を過去に同定した。本研究では、Rim21の生化学的な特徴付けを行った。その結果、Rim21が典型的な糖鎖修飾モチーフとは異なる部位でN型糖鎖修飾を受けることを見出した。さらに、この非典型的な糖鎖付加はRim21の細胞膜内微小領域への局在を調節しており、その結果としてRim21の正常なターンオーバーを制御していることを強く示唆した。近年、細胞膜では局所的に異なる脂質環境を持つ多数の微小領域が離合集散を繰り返しており、そのダイナミックな動的性質によって様々な細胞機能が担われていることが知られてきている。また、細胞膜タンパク質の糖鎖修飾同士の相互作用によって、細胞膜タンパク質同士の結合や微小領域の形成が調節されることも示唆されている。本研究は、非典型的な糖鎖修飾によるRim21の微小領域への局在調節という新たな知見を与えるだけではなく、糖鎖修飾を介した微小領域形成機構の解明に向けた良いモデルケースと成り得る。本研究は東京工業大学、北海道大学との共同研究として実施された。 |
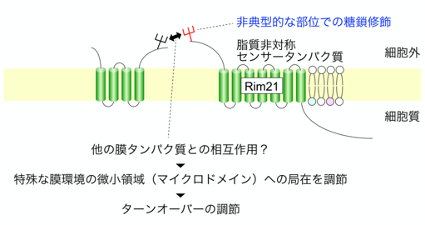 |
| Rim21の非典型的な部位での糖鎖修飾はRim21の細胞膜内微小領域への局在を調節する。 |
| 4) Nakatsukasa, K., Nishimura, T., Byrne, S.D., Okamoto, M., Takahashi-Nakaguchi, A., Chibana, H., Okumura, F., and Kamura, T. The Ubiquitin Ligase SCFUcc1 Acts as a Metabolic Switch for the Glyoxylate Cycle. Molecular Cell (2015) 59, 22-34. |
| グリオキシル酸回路は微生物や植物に特有の代謝経路である。これらの生物はグルコースが不足すると、酢酸や脂肪酸を材料にして、グリオキシル酸回路→クエン酸回路→糖新生という一連の代謝反応によってグルコースを合成する。これまで回路の活性は、グルコースが豊富にあると「オフ」になり、グルコースが不足して、炭素源として酢酸や脂肪酸が細胞内に取り込まれると「オン」になることが知られていたが、スイッチの詳しいメカニズムは明らかにされていなかった。我々は、回路の中で最初の反応を触媒するクエン酸合成酵素(Cit2)に着目し、グルコースが豊富にあるとUcc1がCit2の分解を促進して、回路の活性を抑制することを見出した(オフの状態)。また、グルコースが不足して酢酸や脂肪酸からグルコースを作る必要が生じると、Ucc1がCit2から解離して、安定化したCit2が回路を活性化することも見出した(オンの状態)。本研究は、代謝経路の活性が代謝酵素の「分解」によって制御されるというユニークなスイッチ機構を明らかにしたものといえる。また、SCF
E3リガーゼ複合体による基質の認識は、基質のリン酸化によって制御されることが多いが、本研究は代謝物による基質のコンフォメーション変化が認識の引き金になることを示した。今後、バイオ燃料などの有用物質の生産を目指す代謝工学、感染症の克服を目指す医学などの分野で、Ucc1は重要な「ツール」および「ターゲット」になると期待される。 |
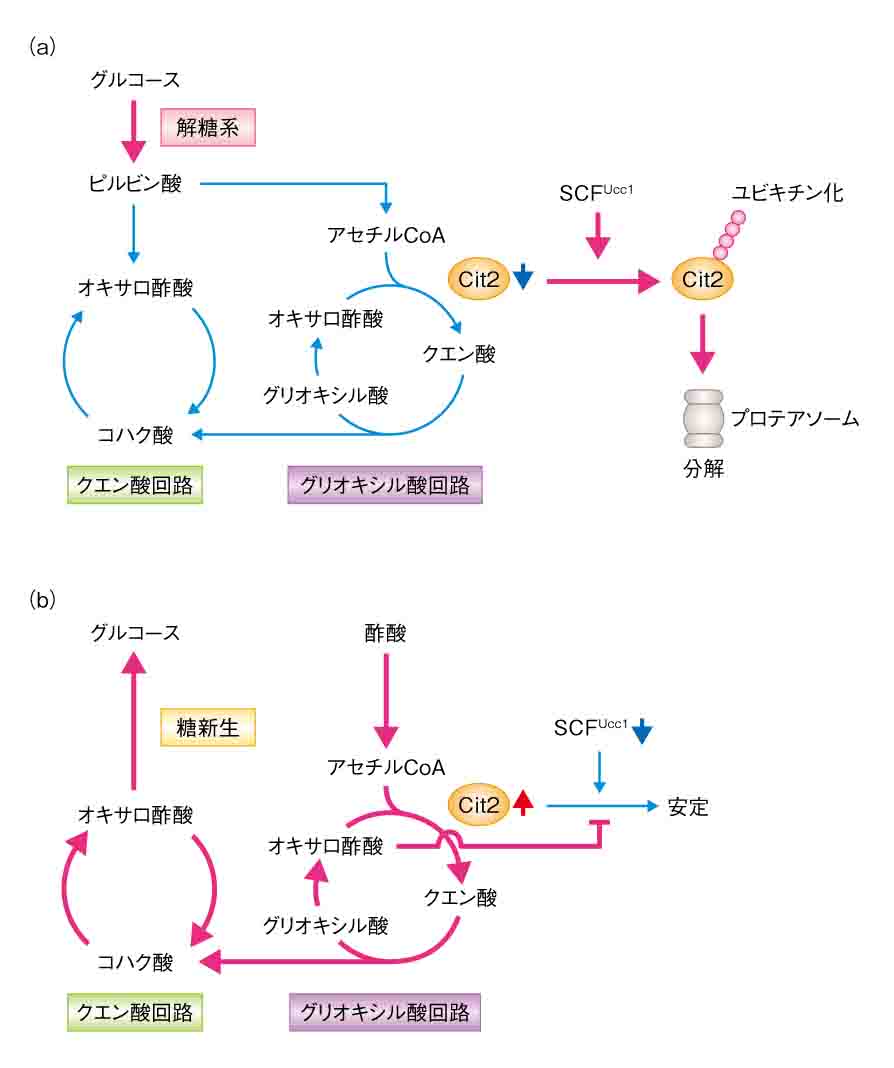 |
| ユビキチンリガーゼSCFUcc1によるグリオキシル酸回路の制御機構 |
| 2) 5) Nakatsukasa, K., Okumura, F., and Kamura, T. Proteolytic regulation of metabolic enzymes by E3 ubiquitin ligase complexes: lessons from yeast. |
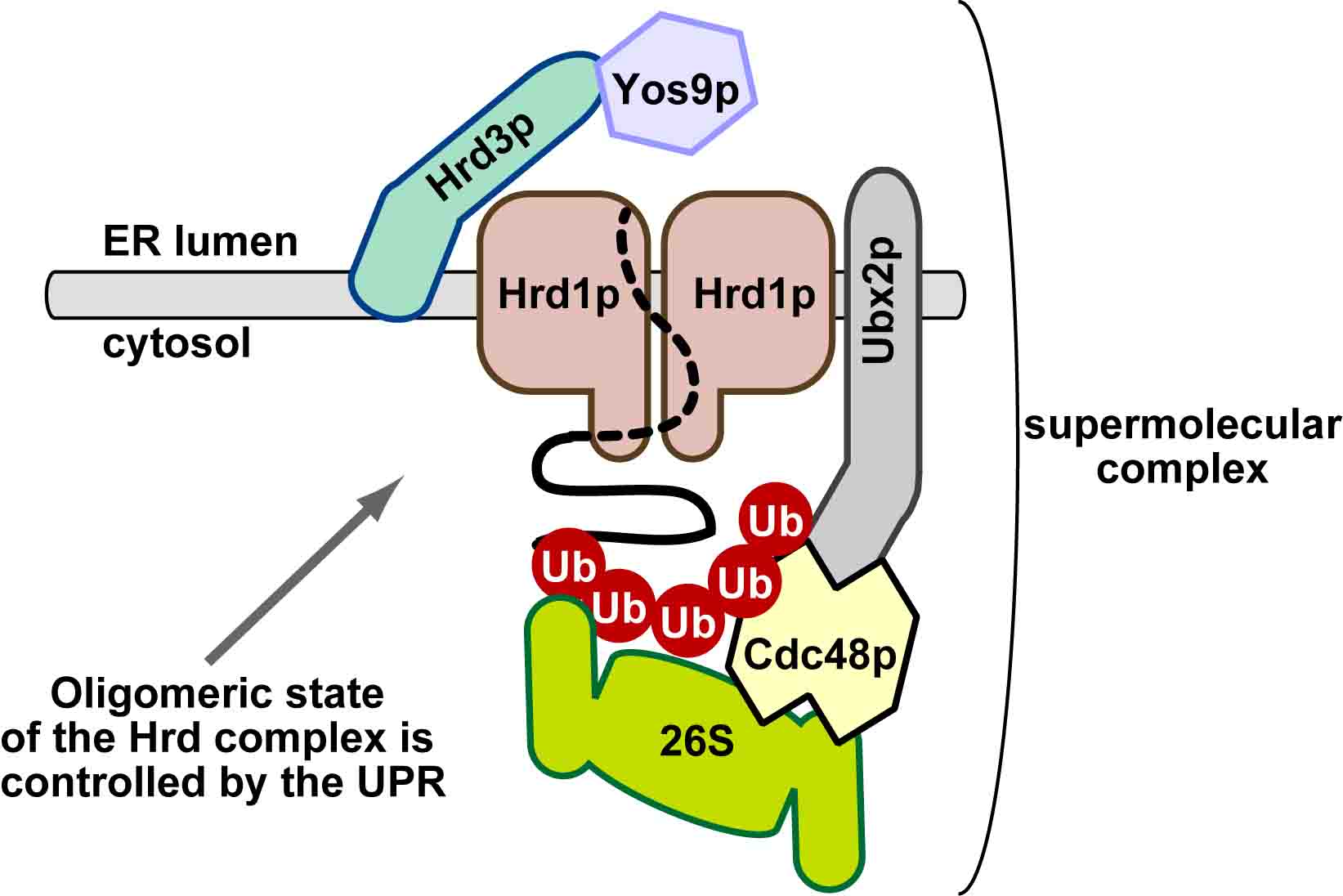
| 細胞内の代謝経路は、代謝酵素の合成(転写・翻訳)、代謝酵素の翻訳後修飾(リン酸化など)などによって調節されている。さらに、上流・下流の代謝産物による「フィードバック」または「フィードフォワード」制御も古くから研究されてきた。これらに加えて、近年、代謝経路は酵素の「分解」によっても制御されうることが明らかになりつつある。ユビキチン・プロテアソーム系は、代表的なタンパク質の分解系であり、様々な細胞機能の制御に関わっている。ユビキチンは、E1(ユビキチン活性化酵素)、E2(ユビキチン結合酵素)、E3(ユビキチンリガーゼ)と呼ばれる3種類の酵素の連続的な反応によって、基質タンパク質に付加される。特に48番目のリジン残基を介して形成されたポリユビキチン鎖は、プロテアソームによって分解されるシグナルとなることが知られている。E1、E2、E3酵素の中で、基質を認識する役割を担っているのがE3である。本総説では、ERADに関わる小胞体膜Hrd1
E3リガーゼ複合体およびDoa10 E3リガーゼ複合体、およびSCF E3リガーゼ複合体に焦点を絞り、これらE3リガーゼ複合体による代謝酵素の制御について、現在までの知見を整理した。 |
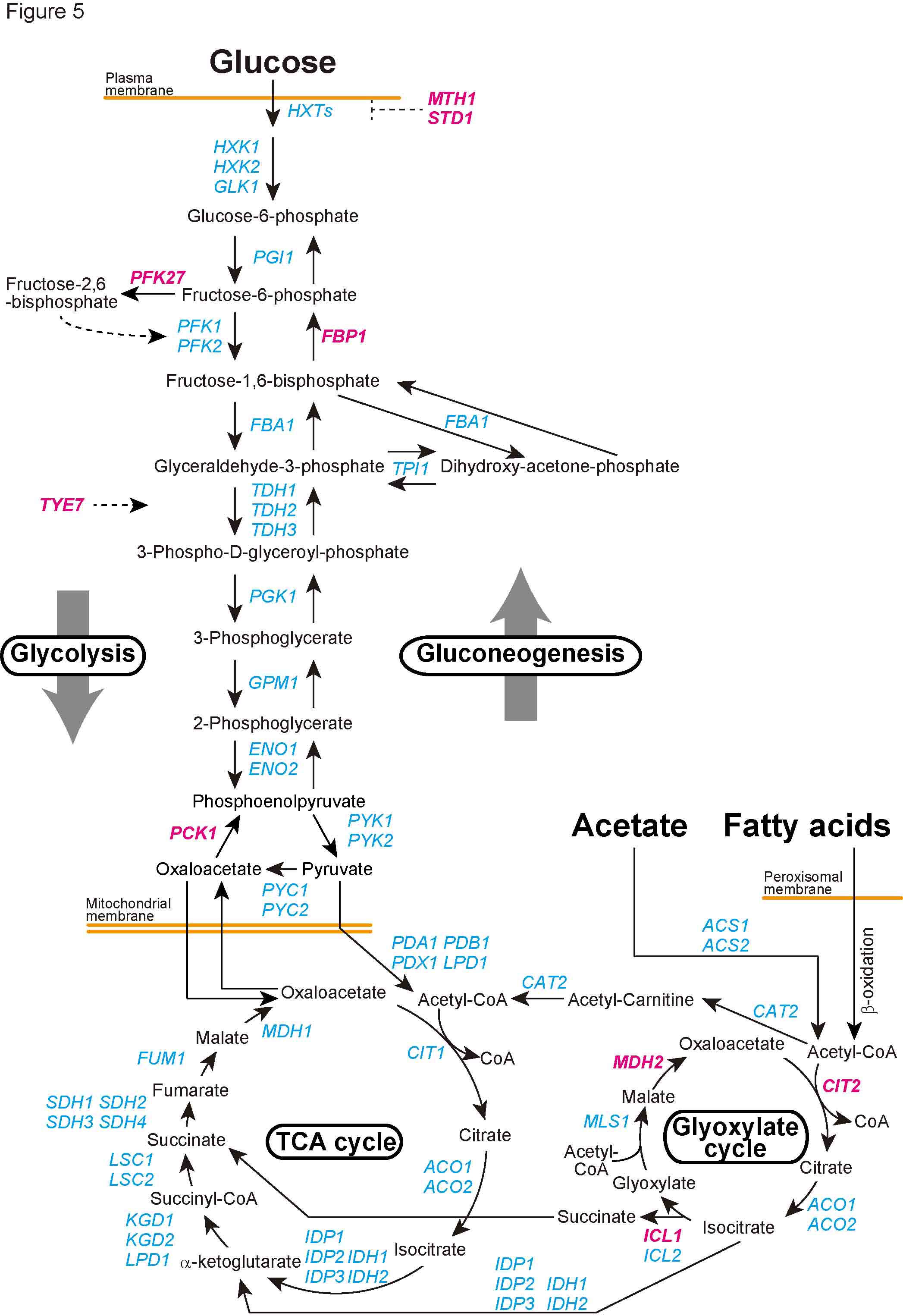 |
| 出芽酵母における解糖系、糖新生、グリオキシル酸回路 (ユビキチンプロテアソーム分解系によって制御される代謝酵素をマゼンタで記した) |
| 7) Okumura, F., Okumura, AJ., Uematsu, K., Hatakeyama, S., Zhang, DE., Kamura, T.: Activation of double-stranded RNA-activated protein kinase (PKR) by interferon-stimulated gene 15 (ISG15) modification down-regulates protein translation. J Biol Chem. 288(4):2839-47. doi: 10.1074/jbc.M112.401851 (2013) |
|
ウイルス由来の2本鎖RNAによって活性化されるPKRが、ISG15修飾を受けることを明らかにした。さらにISG15修飾を受けたPKRの活性化には、ウイルス由来の2本鎖RNAの結合が必要でないことも明らかにした。このPKR活性化機構の解明は、新たなタンパク質翻訳抑制機構の存在を示唆している。 |
 |
| 上に戻る |