べん毛モーター研究グループ
はじめに
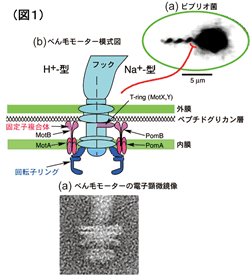 大腸菌やサルモネラ菌の培養液を顕微鏡で観察すると、菌体が液体中をすいすいと泳いでいるのがわかります。核を持たない単細胞生物である細菌は、どのようにして運動するのでしょうか? 細菌はべん毛と呼ばれる体長の数倍の長さのらせん状繊維を表面から生やしており、これがスクリューのように回転することで推進力を得て泳いでいます。べん毛を回転させているのは、繊維の根元の細胞表層に存在する、直径45 nmのタンパク質で出来たモーターで、細胞膜を介したイオンの電気化学的勾配をエネルギー源として回転力を発生させています。(図1)私たちの研究室では、分子生物学・生化学・生物物理学・構造生物学といった様々な手法を駆使して、モーターがどのようにして回転するのか、そのメカニズムを解き明かそうとしています。
大腸菌やサルモネラ菌の培養液を顕微鏡で観察すると、菌体が液体中をすいすいと泳いでいるのがわかります。核を持たない単細胞生物である細菌は、どのようにして運動するのでしょうか? 細菌はべん毛と呼ばれる体長の数倍の長さのらせん状繊維を表面から生やしており、これがスクリューのように回転することで推進力を得て泳いでいます。べん毛を回転させているのは、繊維の根元の細胞表層に存在する、直径45 nmのタンパク質で出来たモーターで、細胞膜を介したイオンの電気化学的勾配をエネルギー源として回転力を発生させています。(図1)私たちの研究室では、分子生物学・生化学・生物物理学・構造生物学といった様々な手法を駆使して、モーターがどのようにして回転するのか、そのメカニズムを解き明かそうとしています。
1)Na+で駆動するべん毛モーター
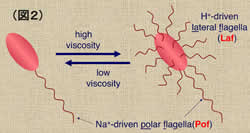
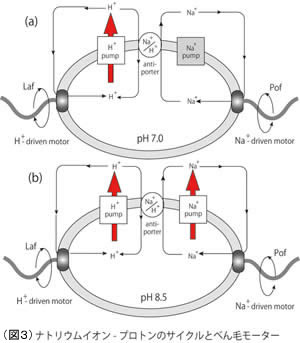
べん毛モーターの研究は、遺伝学が進んでいる大腸菌やサルモネラ菌で発展してきました。これらのモーターは細胞膜を介したH+駆動力をエネルギー源として回転することが分かっています。私たちは、強いアルカリ性環境でのみ生育する好アルカリ菌の運動能は、H+駆動力が小さいpH 10.5付近であることに着目し、モーターはH+ではなくNa+駆動力で回転していることを明らかにしました。(図2)その後、海に生息し遺伝学的解析が比較的容易な海洋性ビブリオ菌の極べん毛がやはりNa+駆動力で回転することを発見し、その回転機構の解析を進めてきました。ちなみに、ビブリオ菌は粘性の低い環境では極べん毛1本だけを生やして泳いでいますが、粘性の高い環境にさらされると、体の側面から多数の側べん毛を生やし、這い回ることが知られています。(図3)側べん毛はNa+ではなくH+で回転することも私たちが明らかにしました。
2)ビブリオ菌のNa+駆動型極べん毛モーター
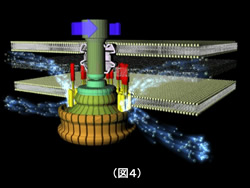
膜に埋まったモーターの基部は、複数のリングと軸で形成され、実際に回転する回転子の部分と、細胞壁に固定され、イオンを透過しエネルギー変換を担う固定子の二つから成り立っています。10数個の固定子が回転子の周囲を取り囲むように配置され、固定子内のチャネルをイオンが流れる際に、固定子-回転子間の相互作用が生じ、回転力が発生すると考えられています。(図4)私たちはビブリオ菌のNa+駆動型極べん毛モーターの回転に必須なタンパク質を4種類(PomA, PomB, MotX, MotY)同定しました。PomAとPomBはそれぞれ膜タンパク質で、PomA4PomB2のヘテロ六量体を形成し、Na+を透過する能力を持つことや、Na+モーターの阻害剤に耐性となる変異がマップされることから、固定子の構成要素であることが分かりました。一方、MotXとMotYはその欠損でモーターは回転できなくなること、膜タンパク質ではなくどうやらペリプラズム側に輸送され、外膜画分にあるらしいこと、程度のことしかわかりませんでした。
3)Tリングの発見
私たちはビブリオ菌極べん毛の基部体を精製し、電子顕微鏡で詳細に観察しているうちに、どうもサルモネラ菌や大腸菌では見られない構造があることに気づきました。それは、モーターの軸受けとしてはたらくPリングの下にある突起のような構造でした。基部体タンパク質を調べてみると、この構造はMotXとMotYから出来ていることが分かり、Tリングと名付けました。(図1)さらに、PomAまたはPomBにGFPを融合して固定子のモーターへの集合を観察すると、Tリングのない株では、固定子の集合が著しく低下していました。すなわち、MotXまたはMotYの欠損株がモーターを回転できないのは、固定子の集合が低下してしまったからだったのです。
4)共役イオンに依存した固定子の集合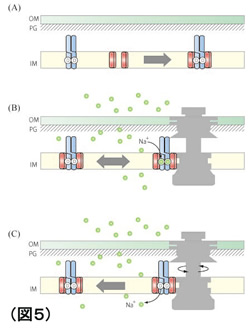
私たちはGFPを融合した固定子を作成し、べん毛が極に1本だけ形成される性質を利用して、GFP蛍光の極局在から固定子の集合を調べました。PomAやPomBのどのアミノ酸残基が集合に大切なのかを調べる過程で、共役イオンのNa+がない時には固定子が極局在せず、細胞膜上に一様に広がっていることを見つけました。この現象は可逆的で、培地のNa+をK+に変えてしまうと局在はなくなりますが、再びNa+を戻してやると速やかに極局在は回復してきます。これまで、固定子は一旦モーターにセットされると安定に保持されると思われていましたが、実は環境のNa+濃度変化に応じてダイナミックに入れ替わっているらしい、ということが分かってきました。(図5)
5)モータータンパク質の構造
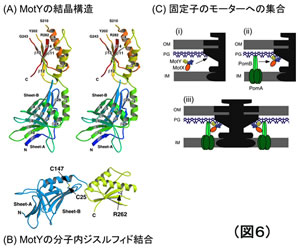 私たちは大阪大学・難波研究室との共同研究で、モーターの構成タンパク質の結晶構造解析も進めています。最初に構造を明らかにしたのはTリングを構成するMotYで、N末端側とC末端側の2つのドメインからなることが分かりました。N末ドメインは新規の構造で、機能解析から示されていた2つのシステイン間の分子内ジスルフィド結合もきちんと見えました。(図6)この結合が欠損するとMotYは不安定になり、さらに相互作用相手のMotXも不安定になってしまいます。C末ドメインには保存されたペプチドグリカン結合モチーフが存在し、ちょうど同じ頃に構造が報告されたPalやRmpMといったペプチドグリカン結合タンパク質と非常に良く似た構造であることが分かりました。各ドメインのみを発現して調べたところ、N末ドメインが基部体とMotXの結合に重要であることがわかり、C末ドメインがペプチドグリカン層と作用することでTリングの安定化が維持されていると考えられました。
私たちは大阪大学・難波研究室との共同研究で、モーターの構成タンパク質の結晶構造解析も進めています。最初に構造を明らかにしたのはTリングを構成するMotYで、N末端側とC末端側の2つのドメインからなることが分かりました。N末ドメインは新規の構造で、機能解析から示されていた2つのシステイン間の分子内ジスルフィド結合もきちんと見えました。(図6)この結合が欠損するとMotYは不安定になり、さらに相互作用相手のMotXも不安定になってしまいます。C末ドメインには保存されたペプチドグリカン結合モチーフが存在し、ちょうど同じ頃に構造が報告されたPalやRmpMといったペプチドグリカン結合タンパク質と非常に良く似た構造であることが分かりました。各ドメインのみを発現して調べたところ、N末ドメインが基部体とMotXの結合に重要であることがわかり、C末ドメインがペプチドグリカン層と作用することでTリングの安定化が維持されていると考えられました。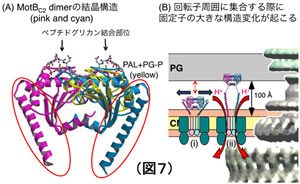
また、サルモネラ菌の固定子MotBのC末端領域の構造も昨年明らかにしました。(図7)ペリプラズム側に存在する可溶性のこの領域は、MotYと同じくペプチドグリカン結合モチーフがある事から固定子の「固定」を担っていると言われてきました。構造を解いてみると、MotY, Pal, RmpMと非常に良く似たコア構造が見られ、ペプチドグリカン層との相互作用は上記のタンパク質と同じようなメカニズムだろうと推測されました。一方で、N末側にはMotBに特徴的な長いヘリックスが存在し、この部分に変異を入れると菌の生育が悪くなるだけでなくモーターへの集合が野生型よりも良くなることを見いだしました。結晶構造は予想以上にコンパクトなC末領域を示していることから、固定子がモーターに組み込まれる際は、この領域の構造変化が誘導されて、安定に固定されると同時にH+透過活性が上昇するのではないかと考えられました。
6)これからの課題
これまでの研究により、モーターを回転させるために必要なタンパク質が明らかとなりました。しかし、どの部分の相互作用が回転力を実際に生み出しているのか? どのくらいのイオンが固定子を流れると何度回転するのか? イオンのエネルギーはどのように固定子内で変換されているのか? といった根本的な疑問はまだ明らかになっていません。さらに、固定子はどうやらモーターに常時組み込まれているのではなく、はずれて膜の上を拡散している状態もあり、そのときはイオン透過活性が低下しているようです。固定子の集合に伴うイオン透過活性制御のメカニズムの解明も重要な課題です。また、私たちはモーターだけに興味があるのではなく、べん毛システムそのものの面白さにも魅せられています。走化性シグナルによるモーター回転制御メカニズムや、極に一本だけべん毛を生やすメカニズムなども面白い研究対象です。これらの研究課題を進めるには、様々な手法が必要となります。私たちは、分子生物学・生化学・生物物理学・構造生物学の手法を用い、積極的な共同研究(国内・国外問わず)も行いながらモーターの回転メカニズムを明らかにしようとしています。関心を持った方は一度研究室にご連絡ください。お待ちしています。